บทความ
Antimicrobial photodynamic therapy: นวัตกรรมที่ทันตแพทย์ควรรู้
เป็นที่ทราบกันดีว่า เชื้อจุลชีพก่อโรคที่อาศัยอยู่ในช่องปาก ไม่ว่าจะเป็น แบคทีเรีย รา หรือไวรัส มีลักษณะทางฟีโนโทป์ และจีโนไทป์ที่แตกต่างจากลักษณะของเซลล์มนุษย์ปกติ ลักษณะที่สำคัญเช่น ไลโปพอลิแซคคาไรด์บนผิวเซลล์ของเชื้อแบคทีเรียนแกรมลบ Porphylomonas gingivalis (Pg) ถือเป็นปัจจัยที่สำคัญที่ก่อให้การอักเสบ1 หรือกรดเทโคอิค (teichoic acid) ในแบคทีเรียแกรมบวก ก็สามารถต่อต้านฤทธิ์การฆ่าเชื้อจุลชีพของยาปฏิชีวนะ2 ดังนั้น แนวคิดการกำจัดเชื้อจุลชีพก่อโรคที่สำคัญในปัจจุบันจึงหันมาใช้สารที่สามารถเข้าไปในเซลล์หรือมีความจำเพาะต่อเชื้อจุลชีพก่อโรคได้ แต่ไม่มีความจำเพาะต่อเซลล์ของมนุษย์ แล้วใช้แสงที่มีพลังงานและความยาวคลื่นที่เฉพาะเจาะจงเพื่อกระตุ้นสารที่จำเพาะต่อเชื้อจุลชีพก่อโรคดังกล่าวให้กลายเป็นองค์ประกอบที่เป็นพิษ โดยเฉพาะองค์ประกอบจากออกซิเจนที่เรียกว่า Reactive oxygen species (ROS) ให้เกิดขึ้นเฉพาะภายในเซลล์ของเชื้อจุลชีพดังกล่าว เพื่อก่อให้เกิดปฏิกิริยาจำเพาะในการการกำจัดเชื้อเหล่านั้น ภายใต้แนวคิดที่เรียกว่า โฟโตไดนามิกบำบัดต้านเชื้อหรือเอพีดีที (anti-microbial photodynamic therapy; aPDT)3
มีการทบทวนวรรณกรรมอย่างเป็นระบบและ meta-analysis พบว่า วิธีการเอพีดีทีนี้ให้ผลดีเท่ากับการต้านเชื้อจุลชีพก่อโรคในทางปริทันต์ด้วยยาต้านเชื้อจุลชีพ4 แต่ไม่ก่อการดื้อต่อการรักษา เพราะเอพีดีทีใช้ปฏิกิริยาที่ทางกายภาพเป็นหลักในการต้านเชื้อ ข้อดีของวิธีโฟโตไดนามิกบำบัดคือ มีความจำเพาะเจาะจงต่อเซลล์เป้าหมายโดยไม่ทำให้เกิดความเสียหายต่อเซลล์ข้างเคียง สามารถทำซ้ำได้ ไม่มี่เจ็บปวด5
ปัจจัยสำคัญที่สุดในความสำเร็จของการใช้โฟโตไดนามิกบำบัดต้านเชื้อคือ การเลือกสารที่จำเพาะเจาะจงกับเชื้อจุลชีพในช่องปากและเป็นสารไวแสง (photosensitizer; PS) ซึ่งมีการยอมรับกันในทางคลินิกว่า อีริโทรซิน (erythrosine) เป็นสารที่มีความจำเพาะต่อเชื้อจุลชีพที่ใช้ในการย้อมคราบจุลินทรีย์มาเป็นเวลานาน ที่น่าสนใจคือ อีริโทรซินมีสมบัติเป็นสารไวแสงที่ดีด้วย โดยอีริโทรซินสามารถดูดซับพลังงานแสงสีเขียวได้ดี โดยเฉพาะที่ความยาวคลื่น 526 นาโนเมตร6 ข้อดีที่เป็นประโยชน์ในทางทันตกรรมคือ สารชนิดนี้สามารถดูดซับพลังงานจากแสงสีฟ้าทางทันตกรรมได้ดีในระดับหนึ่ง6 (รูปที่ 1)
ดังนั้น จึงมีการศึกษาที่พยายามนำแสงสีฟ้าที่ใช้ในทางทันตกรรมเพื่อประยุกต์ใช้ร่วมกับอีริโทรซิน โดย Teerakapong และคณะในปี ค.ศ. 2017 พบว่า การใช้อีริโทรซินความเข้มข้น 440 ไมโครโมลาร์ร่วมกับไทเทเนียมไดออกไซด์ (Nano TiO2) ความเข้มข้นร้อยละ 1 โดยมวลของอีริโทรซิน เมื่อฉายแสงสีฟ้าพลังงาน 15 จูลต่อตารางเซนติเมตร (250 mW/cm2) ฉายนาน 1 นาที ที่ระยะห่างจากเชื้อราแคนดิดาส์ชนิดไบโอฟิล์มในห้องปฏิบัติการ 2 เซนติเมตร สามารถยับยั้งเชื้อราแคนดาส์ในรูปแบบไบโอฟิล์มได้ประมาณ 2log10 CFU/ml7 ซึ่งกลไกหลัก ๆ ในการต้านเชื้อ ได้จากผลผลิตที่ชื่อว่า ซิงเกล็ตออกซิเจน (singlet oxygen; 1O2) ส่วนไทเทเนียมไดออกไซด์ ที่ใส่ไปทำหน้าที่เป็นตัวเพิ่มปฏิกิริยาจากแสง เนื่องจากพบว่า กลุ่มที่มีอีริโทรซินที่ใส่นาโนไทเทเนียมไดออกไซด์จะทำให้เกิดซิงเกล็ตออกซิเจนที่มากกว่ากลุ่มที่ไม่ได้ใส่7 โดยซิงเกล็ตออกซิเจนที่มากจะทำให้เกิดการต้านเชื้อจุลชีพได้ย่างมีประสิทธิภาพมากขึ้น8 อย่างไรก็ดี ความเข้มข้นที่มากของอีริโทรซินมีผลต่อเซลล์ปกติของมนุษย์ได้
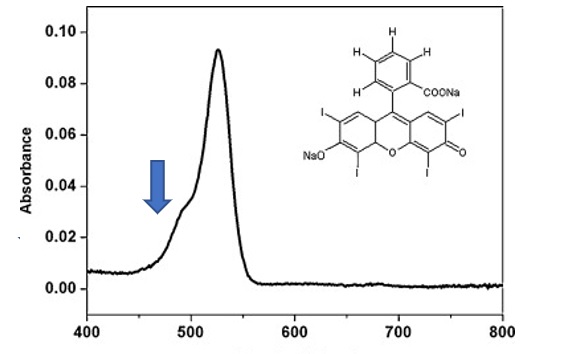
ความยาวคลื่น (นาโนเมตร)
รูปที่ 1 กราฟความสามารถในการดูดกลืนแสงของอีริโทรซิน ลูกศรแสดง ความยาวคลื่นมาตรฐานของแสงสีฟ้าทาง ทันตกรรม (ดัดแปลงจาก Costa et al, 20116)
ปฏิกิริยาการรับพลังงานจากแสงแล้วทำให้เกิดสารพิษตระกูลออกซิเจน ไม่ได้มีเฉพาะการสร้างซิงเกล็ตออกซิเจนเท่านั้น มีการค้นพบว่า สารสกัดจากขมิ้นชัน ที่ชื่อว่า สารกลุ่มเคอร์คิวมินอยด์ (curcuminoid) ก็สามารถทำให้เกิดปฏิกิริยาสร้างสารอีกกลุ่มคือ อนุมูลอิสระไฮดรอกซิล (hydroxyl radical; OH-) ซึ่งถือเป็นผลผลิตจากปฏิกิริยาหลักอีกปฏิกิริยาของโฟไตไดนามิกบำบัด ข้อดีที่สำคัญอีกประการของสารเคอร์คิวมินอยด์คือ สามารถเกาะติดกับโครงสร้างชั้นนอกของเชื้อแบคทีเรียและเชื้อราได้ดี9,10 ดังนั้นจึงมีแนวคิดในการนำสารสองชนิด คือ สารกลุ่มเคอร์คิวมินอยด์ผสมกับอีริโทรซิน เพื่อให้เกิดอนุมูลอิสระที่มากพอในการต้านเชื้อ พบว่า การใช้อีริโทรซินเพียง 220 ไมโครโมลาร์ร่วมกับอนุพันธ์ที่มีความสามารถในการสร้างอนุมูลอิสระไฮดรอกซิลได้ดีที่ชื่อว่า บิสดีเมท็อกซีเคอร์คิวมิน (bisdemethoxy curcumin; BDMC) ปริมาณ 20 ไมโครโมลาร์และนาโนไทเทเนียมไดออกไซด์ความเข้มข้นร้อยละ 10 โดยมวลของสารผสมทั้งสอง เมื่อได้รับแสงสีฟ้าในทางทันตกรรมกำลัง 3,200 mW/cm2 ฉายเป็นเวลา 21 วินาทีเพียงครั้งเดียว สามารถลดเชื้อราแคนดิดาในรูปแบบไบโอฟิล์มได้อย่างมีประสิทธิภาพ โดยไม่มีอันตรายต่อเซลล์ปกติได้แก่ เซลล์เหงือกของมนุษย์ แต่อย่างใด10 อย่างไรก็ตาม การต้านเชื้อราด้วยวิธีโฟโตไดนามิกบำบัด ด้วยอีริโทรซินร่วมกับเคอร์คิวมินอยด์ยังมีฤทธิ์การต้านเชื้อราที่ไม่ดีนักเมื่อเทียบยาต้านเชื้อรามาตรฐาน ได้แก่ นิสแททิน จึงต้องมีการพัฒนาต่อไป แต่ด้วยความสามารถของวิธีโฟโตไดนามิกบำบัดที่มีความจำเพาะกับเชื้อจุลชีพ แต่ไม่ทำให้เกิดการดื้อยาหรือการต้านต่อการรักษาได้ โฟโตไดนามิกบำบัดต้านเชื้อ จึงถือเป็นวิธีการรักษาที่น่าจะใช้เป็นหลักในการจัดการการติดเชื้อในช่องปากต่อไป